مفهوم ph
در این بخش شما را با یکی از مهمترین قسمت های مبحث اسیدها و بازها آشنا می کنیم که آن مفهوم مقیاسی است برای خاصیت اسیدی که PH خوانده می شود. با ما همراه باشید.

مقیاس PH:
در اواخر سده ی نوزدهم برخی صاحبان صنایع شیمیایی جهت بهینه سازی شرایط تخمیر در کارخانه های خود به دانستن مقدار و شیوه ی کنترل میزان اسیدی بودن محیط فعالیت مخمرها، نیازمند شدند. زیرا به علت تغییر غلظت یون هیدرونیم در طول فرایند تخمیر میزان اسیدی بودن این محیط پیوسته تغییر می کرد. از طرفی غلظت یون هیدرونیم معمولاً عدد بسیار کوچکی بود و کارکردن با آن دشوار بود، به همین دلیل نخستین بار دانشمندی دانمارکی به نام «سورن پیتر لاریتس سورن سن» در سال 1909 میلادی معیاری برای اندازه گیری میزان اسیدی بودن محلول ها پیدا کرد که آن را با یک عدد ساده نشان می داد. سورن سن نام این معیار را PH گذاشت.
PH =- log [H3O+]
طبق این رابطه هر چه غلظت H3O+ بیش تر باشد محیط اسیدی تر بوده و PH کمتر است، هم چنین اگر غلظت [H3O+]کمتر باشد خاصیت اسیدی محلول کمتر و PH بیش تر است.
نکته: در دمای اتاق (25℃) گستره ی PH از صفر تا 14 است.
نکته: PH آب خالص و محلول های خنثی 7، PH محلول های اسیدی کمتر از F و PH محلول های بازی بیش تر از F است.

مقیاس POH:
برای مقایسه خاصیت بازی نیز می توان از غلظت یون هیدروکسید، منفی لگاریتم گرفت و به مقیاسی به نام POH رسید.
هر چه مقدار POH کمتر باشد غلظت OH- بیش تر و محیط بازی تر است و بر عکس هر چه مقدار POH بیش تر باشد، یعنی غلظت OH- کمتر بوده و خاصیت بازی محیط کمتر است.
نکته: گستره ی POH در دمای (25℃) از صفر تا 14 بوده که در آن صفر تا 7 برای محلول های بازی، 7 برای محیط خنثی و 7 تا 14 برای محلول های اسیدی دسته بندی می شود.
رابطه ی بین PH و POH:
با توجه به توضیحاتی که در بالا ارائه شد می توان دریافت هر چه PH بیش تر باشد POH کمتر است، یعنی این دو با هم رابطه ی عکس دارند. به یاد دارید که Kw = [H3O+] [OH-] ، اگر از طرفین این معادله منفی لگاریتم بگیریم خواهیم داشت:
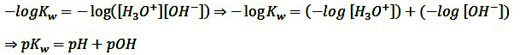
با توجه به اینکه در دمای (25℃) مقدار PKw برابر 14 است می توان نوشت: PH+POH=14
نکته ی مهم:
به یاد دارید که قبلاً معیاری به نام Ka برای مقایسه ی قدرت اسیدی معرفی شد و در اینجا با مقیاس PH برای مقایسه ی خاصیت اسیدی آشنا شدید. سوالی که پیش می آید این است که تفاوت این دو در چیست؟ آیا قدرت اسیدی با خاصیت اسیدی تفاوت دارد؟ در جواب باید بگوییم بله. قدرت اسیدی به غلظت اسید بستگی ندارد و از روی Ka تعیین می شود که فقطه به وسیله ی دما دچار تغییر می شود امّا خاصیت اسیدی تابع غلظت اسید است چون هر چه غلظت یک اسید بیش تر باشد غلظت [H3O+] بیش تر و PH کمتر می شود و این نشان می دهد خاصیت اسیدی بیش تر است.
به یاد داشته باشید خاصیت اسیدی تحت تاثیر قدرت اسیدی قرار می گیرد. به عنوان مثال PH محلول HCL از PH محلول HNO2 با غلظت های یکسان کمتر است چون HCL قدرتمند تر بوده و بیش تر یونیده می شود در نتیجهH3O+ بیش تر تولید می کند و PH آن کمتر است.